Andrea Nogara
UOSD Diabetologia e Malattie del Ricambio Ospedale di Chioggia (VE)
DEFINIZIONE
L’induratio penis plastica (IPP) è un’anormalia acquisita della tunica albuginea, caratterizzata da fibrosi con formazione di placche, che può accompagnarsi o no a dolore, deformità e deviazioni del pene, disfunzione erettile e che spesso comporta un importante impatto psico-sociale.
EPIDEMIOLOGIA
L’età media di comparsa è 55-60 anni e la prevalenza varia da 0.5 a 9%, aumenta con l’età ed è maggiore (20%) nei pazienti affetti da disfunzione erettile e diabete mellito (1). Si pensa che la prevalenza reale sia più elevata, ma sottostimata per l’imbarazzo a parlarne da parte dei pazienti, la scarsa conoscenza di possibili rimedi, o perché i sintomi non vengono considerati in grado di compromettere la vita sessuale (2).
Fattori di rischio sono considerati il diabete, l’ipertensione arteriosa, la dislipidemia, le malattie cardio-vascolari, il fumo di sigaretta, l’abuso di alcool e l’associazione con la sindrome di Dupuytren (3).
FISIOPATOLOGIA ED EZIOPATOGENESI
La causa di tale patologia è multi-fattoriale e ancora poco conosciuta. La teoria prevalente è che la fibrosi della tunica albuginea sia conseguenza di un trauma micro-vascolare, o di ripetuti micro-traumi, dell’asta del pene, con deformazione dello stesso, che avvengono durante i rapporti sessuali (4). Nonostante ciò, la maggior parte dei pazienti non ricorda che alcun evento traumatico abbia preceduto l’inizio della sintomatologia.
Attualmente la maggior parte degli autori propende per una patogenesi caratterizzata da un’alterazione del processo di riparazione dopo traumi o micro-traumi che si sviluppa in individui geneticamente e/o immunologicamente predisposti (5). Il TGF-ß1 è la più importante citochina fibrogenica coinvolta nel processo di fibrosi e di formazione delle placche della tunica albuginea (6).
Vi è frequentemente un’associazione con la presenza di altre malattie caratterizzate da fibrosi (fibromatosi palmare, della fascia plantare del piede, timpanosclerosi), con la malattia di Paget e con la presenza di aplotipo HLA B27 (7).
In sintesi, la causa di tale patologia potrebbe essere un’alterata risposta infiammatoria a un trauma o ripetuti micro-traumi in soggetti geneticamente predisposti.
CLINICA
La storia naturale dell’IPP si divide in una fase acuta e una cronica.
La prima fase può durare dai 6 ai 18 mesi ed è caratterizzata dalla predominanza dei processi infiammatori, con comparsa delle placche fibrose, della loro evoluzione con deformazione e curvatura del pene e solitamente dolore sia nella fase flaccida che durante l’erezione (8).
Segue la fase cronica (sintomi invariati da almeno 3 mesi), con la stabilizzazione delle placche, più solide, calcifiche e delle deformità peniene (tipicamente dorsali, dorso-laterali, ventrali) e con la scomparsa della sintomatologia dolorosa entro 12 mesi. Talvolta compare disfunzione erettile.
Se non si avvia un trattamento, le deformazioni peniene migliorano spontaneamente solo nel 12-13% dei casi, rimangono stabili in circa il 40-47% e peggiorano nel 40-48% (9).
DIAGNOSI
La diagnosi di IPP si ottiene dalla storia clinica del paziente e dalla valutazione del pene. L’anamnesi deve essere accurata e comprendere informazioni circa l’inizio dei sintomi e la possibile relazione con un trauma penieno durante il coito, la progressione o la stabilità delle deformazioni peniene e se queste interferiscono con il rapporto sessuale. Va indagata inoltre la presenza di disfunzione erettile. Poiché si tratta di un quadro morboso con forte impatto psico-sociale, vanno indagati il tono dell’umore e lo stato relazionale del paziente, anche in previsione di un approccio terapeutico multi-disciplinare. È stato validato a questo proposito un questionario di valutazione, in grado di misurare gli effetti psico-sessuali della presenza di IPP e della risposta al trattamento, il PDQ (10).
L’esame del pene comprende:
- la localizzazione delle placche e della loro consistenza (soffice o calcifica);
- le deformazioni (pene a clessidra, a cerniera) e l’angolo di curvatura del pene, meglio durante erezione, mediante iniezione intra-cavernosa di sostanza vaso-attiva o, in alternativa, utilizzando documentazione fotografica portata dal paziente (11);
- la misura della lunghezza del pene, anche in previsione di un trattamento chirurgico, in modo che il paziente comprenda che la perdita di lunghezza del pene dipende da IPP e non dall’atto chirurgico;
- la valutazione della disfunzione erettile mediante questionario IIEF;
- eventualmente, se presente, esecuzione di eco-doppler penieno, per la valutazione dell’assetto vascolare. L’ecografia del pene permette inoltre la localizzazione esatta delle placche, la loro misura e grado di calcificazione.
Metodo per calcolare l’angolo di curvatura
Vanno valutate, in corso di esame obiettivo, anche le altre possibili sedi di fibrosi: palmo delle mani e pianta dei piedi.
Non sono necessari esami di laboratorio per la diagnosi, tranne che per confermare la presenza degli altri fattori di rischio per IPP, come diabete e malattie cardio-vascolari. In caso di concomitante disfunzione erettile, è utile la valutazione funzionale dell’asse ipotalamo-ipofisi-gonadi.
TRATTAMENTO
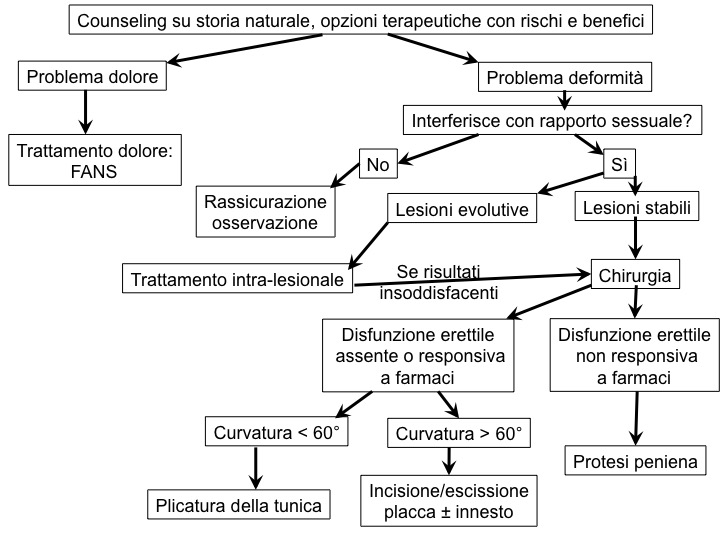
Il trattamento dell’IPP è sia medico che chirurgico; esistono inoltre altre forme di trattamento non chirurgico (meccanica e radiante). La terapia mira alla risoluzione della sintomatologia clinica e al ripristino della competenza coitale. Tiene inoltre in considerazione i disagi psico-sociali che possono emergere, indirizzando eventualmente il paziente verso una terapia psicologica o sessuale.
La terapia è diversa a seconda della fase clinica in cui si trova il paziente (acuta o cronica) e a seconda della presenza o meno di disfunzione erettile.
Nel caso di curvature minime del pene, che non impediscono l’attività sessuale, e assenza di disfunzione erettile, si attua unicamente il counseling e l’osservazione clinica. Per tutti gli altri casi si procede al trattamento.
Terapia farmacologica
Nella prima fase della malattia, infiammatoria, si attua unicamente terapia medica, in quanto l’approccio chirurgico può essere fatto solo dopo 3-6 mesi di stabilizzazione delle lesioni e degli altri disturbi, per non incorrere in ulteriore ripresa di malattia dopo l’intervento (12). L’utilizzo può essere esteso anche alla fase cronica in pazienti che rifiutano o non gradiscono la terapia chirurgica (13).
Sono stati utilizzati numerosi farmaci, da soli o in combinazione, per os, per via trans-dermica o intra-lesionale, con l’intento di stabilizzare le placche e fermarne l’evoluzione, riducendo il grado di curvatura: vitamina E, tamoxifene, procarbazina, acidi grassi omega-3, combinazione di vitamina E con L-carnitina non sono più raccomandati dalle Linee Guida americane per mancanza di evidenze convincenti sulla loro efficacia (14).
La sintomatologia dolorosa, tipica della prima fase della IPP, può essere controllata agevolmente mediante FANS.
I farmaci attualmente più utilizzati sono:
- il potassio para-amino-benzoato (POTABA), che con azione anti-infiammatoria e anti-fibrotica può stabilizzare la placca, pur se costoso e con qualche importante effetto collaterale gastrointestinale e cutaneo (15);
- la terapia topica con verapamile, utilizzata con una certa efficacia per ridurre la deposizione di materiale extra-cellulare a livello della placca, non ha documentato a livello istologico una reale presenza del farmaco al suo interno (16);
- la iontoforesi e altri sistemi che facilitano il trasporto trans-dermico di un farmaco all’interno della placca sono stati utilizzati per veicolare verapamile e verapamile più desametasone con una certa efficacia, ottenendo una riduzione della placca e della curvatura peniena (17).
La terapia intra-lesionale ha invece il razionale di veicolare il farmaco ad alta concentrazione direttamente nella placca. Sono stati usati corticosteroidi (senza risultato), calcio-antagonisti come verapamile (con risultati positivi su volume delle placche, della curvatura peniena e della funzione erettile). L’uso di interferone alfa2-beta riduce la proliferazione di fibroblasti e la produzione di matrice extra-cellulare, con miglioramento della curvatura peniena, del dolore e della funzione erettile (18). L’unico farmaco approvato dalla FDA per la cura intra-lesionale dell’IPP è la Collagenasi del Clostridium Histolyticum, in quanto è in grado di degradare le varie componenti del collagene che compongono la placca. Per tale ragione il farmaco viene utilizzato anche nella fase cronica dell’IPP. Si è ottenuto un miglioramento della curvatura peniena nel 34% dei soggetti partecipanti allo studio in fase III di registrazione. Tra gli effetti collaterali di questa terapia poco invasiva sono riportati ecchimosi del pene, rigonfiamento e dolore locale (19).
Al momento attuale tuttavia non esiste una terapia medica gold standard.
Altre terapie non chirurgiche
La radioterapia a basse dosi ha dimostrato sperimentalmente effetti anti-infiammatori, ma anche importanti effetti collaterali per i quali non è raccomandata (14).
Terapie meccaniche per ridurre la dimensione delle placche e migliorare la curvatura peniena (terapia fisica con onde d’urto, Vacuum device e Penile Extender) hanno mostrato studi di efficacia contraddittori.
Promettente (almeno in modelli animali) l’utilizzo di cellule staminali in grado di rigenerare la tunica albuginea (20).
Trattamento chirurgico
La terapia chirurgica si attua (21):
- dove una terapia conservativa ha fallito;
- per consentire il rapporto sessuale quando le deformità del pene non lo permettono;
- in presenza di placche molto estese e quando il paziente, con lesioni stabili, desidera una rapida soluzione del problema.
Il trattamento chirurgico va eseguito nella fase cronica dell’IPP, a circa 12-18 mesi dalla comparsa della malattia e dopo almeno 3-6 mesi di stabilità delle lesioni.
L’atto chirurgico deve essere preceduto da un accurato esame obiettivo della curvatura e delle deformità del pene, nonché della lunghezza e della circonferenza. La lunghezza è un particolare importante soprattutto in previsione della scelta dell’intervento chirurgico. Va valutata anche la sensibilità al tatto e la funzione vascolare con ecografia (21). Deve infine seguire la discussione con il paziente sulle realistiche aspettative e limitazioni dell’intervento, ponendo l’accento sul fatto che la chirurgia non ha come obiettivo riportare la situazione peniena come prima della comparsa dell’IPP, quanto di ripristinarne la funzione. Possibili complicanze post-chirurgiche sono: residua deformazione peniena, accorciamento del pene, ridotta sensibilità e rigidità, comparsa di disfunzione erettile, ematomi e fimosi (22).
Per deviazioni peniene con angolo di curvatura < 60-70°, senza deformazioni instabili del tipo a clessidra e con lunghezza adeguata, senza disfunzione erettile, l’opzione chirurgica più semplice consiste nell’accorciamento della tunica albuginea mediante incisione/escissione o plicatura della parte convessa del pene (opposta alla placca), con conseguente accorciamento della lunghezza del pene che di solito è < 1 cm (23).
Per curvature peniene > 60-70° con deformazioni del pene tipo a clessidra o instabili, precedente adeguata funzionalità erettile (o buona risposta all’erezione farmaco-indotta), l’opzione chirurgica è quella dell’allungamento del pene mediante incisione o parziale escissione della placca (parte concava della curvatura) e riempimento della tunica con materiale di innesto (24). Tale procedura risulta più lunga e necessita di innesti che possono essere costituiti da materiale autologo (grasso dermico, tessuto venoso, mucosa buccale, prepuzio), non autologo (sottomucosa del tenue di suino, derma porcino, pericardio bovino) o sintetico (meno usati perché anelastici: Dacron, Teflon o Goretex) (21).
Infine nei pazienti con funzione erettile non adeguata e che non risponde a trattamento medico, l’opzione chirurgica migliore è l’impianto protesico, che è in grado di correggere sia IPP che disfunzione erettile (24).
La chirurgia in sostanza, in attesa di un trattamento medico efficace, risulta il gold standard nel trattamento della IPP.
BIBLIOGRAFIA
- Arafa M, Eid H, El-Badry A, et al. The prevalence of Peyronie disease in diabetic patients with erectile dysfunction. Int J Imp 2007, 19: 213-7.
- Di Benedetti DB, Nguyen D, Zografos L, et al. A population-based study on Peyronie’s disease: prevalence and treatment patterns in the United States. Adv Urol 2011, 2011: 282503.
- Rhoden EL, Riedner CE, Fuchs SC, et al. A cross-sectional study for the analysis of clinical, sexual and laboratory condictions associated to Peyronie’s disease. J Sex Med 2010, 7: 1529-37.
- Bjekic MD, Vlajinac HD, Sipetic SB, et al. Risk factors for Peyronie’s disease: a case-control study. BJU Int 2006, 97: 570-4.
- Qian A, Meals RA, Rajfer J, et al. Comparison of gene expression profiles between Peyronie’s disease and Dupuytren’s contracture. Urology 2004, 64: 399-404.
- Haag SM, Hauck EW, Szardening-Kirchner C, et al. Alterations in the transforming growth factor (TGF)-beta pathway as a potential factor in the pathogenesis of Peyronie’s disease. Eur Urol 2007, 51: 255-61.
- Ralph DJ, Schwartz G, Moore W, et al. The genetic and bacteriological aspects of Peyronie’s disease. J Urol 1997, 157: 291-4.
- Mulhall JP, Creech SD, Boorjian SA. Subjective and objective analysis of the prevalence of Peyronie’s disease in a population of men presenting for prostate cancer screening. J Urol 2004, 171: 2350-3.
- Mulhall JP, Schiff J, Guhring P. An analysis of the natural history of Peyronie’s disease. J Urol 2006, 175: 2115-8.
- Karin S, Coyne MPH, Brooke M, et al. The test-retest reliability of the Peyronie’s disease questionnaire. J Sex Med 2015, 12: 543-8.
- Ohebshalom M, Mulhall J, Guhring P, et al. Measurement of penile curvature in Peyronie’s disease patients: comparison of three methods. J Sex Med 2007, 4: 199-203.
- Jordan GHM. Peyronie’s disease. In: Kavoussi LR ed. Campbell-Walsh Urology, Vol 1, 10th ed, Philadelphia: Elsevier Saunders 2012: 792-809.
- Ralph D, Gonzalez-Cadavid N, Mirone V, et al. The management of Peyronie’s disease: evidence-based 2010 guidelines. J Sex Med 2010, 7: 2359-74.
- Ajay N, Ralph A, Daniel J, et al. Peyronie’s disease: AUA guideline. J Urol 2015, 194: 745-53.
- Weidner W, Hauck EW, Schnitker J. Potassium paraaminobenzoate (POTABA) in the treatment of Peyronie’s disease: a prospective, placebo-controlled, randomized study. Eur Urol 2005, 47: 530-5.
- Martin DJ, Badwan K, Parker M, et al. Transdermal application of verapamil gel to the penile shaft fails to infiltrate the tunica albuginea. J Urol 2002, 168: 2483-5.
- Di Stasi SM, Giannantoni A, Stephen RL, et al. A prospective, randomized study using transdermal electromotive administration of verapamil and dexamethasone for Peyronie’s disease. J Urol 2004, 171: 1605-8.
- Hellstrom WJ, Kendirci M, Matern R, et al. Single-blind, multicenter, placebo controlled, parallel study to assess the safety and efficacy of intralesional interferon alpha-2B for minimally invasive treatment for Peyronie’s disease. J Urol 2006, 176: 394-8.
- Gelbard M, Goldstein I, Hellstrom WJ, et al. Clinical efficacy, safety and tolerability of collagenase clostridium histolyticum for the treatment of Peyronie disease in 2 large double-blind, randomized, placebo controlled phase 3 studies. J Urol 2013, 190: 199-207.
- Castiglione F, Hedlund P, Van der Aa F, et al. Intratunical injection of human adipose tissue-derived stem cells prevents fibrosis and is associated with improved erectile function in a rat model of Peyronie’s disease. Eur Urol 2013, 63: 551-60.
- Levine LA, Larsen SM. Surgery for Peyronie’s disease. Asian J Androl 2013, 15: 27-34.
- Greenfield JM, Lucas S, Levine LA. Factors affecting the loss of length associated with tunica albuginea plication for correction of penile curvature. J Urol 2006, 175: 238-41.
- Segal RL, Burnett AL. Surgical management for Peyronie’s disease. World J Mens Health 2013, 31: 1-11.
- Kadioglu A, Akman T, Sanli O, et al. Surgical treatment of Peyronie’s disease: a critical analysis. Eur Urol 2006, 50: 235-48.
- Yafi FA, Sangkum P, McCaslin IR, et al. Strategies for penile prosthesis placement in Peyronie’s disease and corporal fibrosis. Curr Urol Rep 2015, 16: 21.
