Alessandro Pizzocaro e Fiore Pelliccione
UO Endocrinologia e Andrologia Medica, Istituto Clinico Humanitas, IRCCS, Rozzano (MI)
DEFINIZIONE ED EPIDEMIOLOGIA
La sindrome della bassa via urinaria (LUTS, Lower Urinary Tract Symptoms) comprende l’insieme dei disturbi urinari di riempimento e svuotamento secondari a ostruzione vescicale (OsVe) da ipertrofia prostatica benigna (IPB) e/o a vescica iperattiva (OAB). La prevalenza aumenta progressivamente con l’età, raggiungendo dopo i 65 anni il 50% e dopo gli 80 anni il 70% (1).
CLINICA
I sintomi possono essere classificati in:
- disturbi del riempimento: incremento frequenza, urgenza minzionale, nicturia, incontinenza;
- disturbi dello svuotamento: difficoltà a iniziare il mitto, flusso debole, disuria (intesa come dolore, bruciore o “fastidio” minzionale);
- disturbi post-minzionali (incompleto svuotamento vescicale, sgocciolamento terminale).
Possono presentarsi da soli o variamente combinati con decorso spesso intermittente e possono provocare disturbi del sonno, depressione e riduzione della capacità lavorativa. In oltre il 70% dei casi si associano a disfunzione erettile (DE) (2).
EZIOLOGIA
In passato si riteneva che i LUTS fossero prevalentemente determinati da OsVe/IPB. Attualmente si dà maggiore importanza ad altri fattori, quali OAB e iperattività del muscolo detrusore vescicale.
Ostruzione vescicale da ipertrofia prostatica benigna: un incremento volumetrico prostatico clinicamente rilevante determina sintomi da mancato svuotamento progressivamente ingravescenti fino alla ritenzione urinaria acuta.
Ostruzione vescicale da altre cause: stenosi uretrale, ostruzione primitiva o contrattura del collo vescicale, alterazioni della sinergia destrusore-sfintere (i.e. da sclerosi multipla o mielo-lesione).
Vescica iperattiva ed iperattività del detrusore: OAB è spesso correlata all’iperattività del detrusore e si associa più frequentemente a disturbi del riempimento di tipo irritativo rispetto a quelli dello svuotamento. Le cause di OAB, spesso non note, possono essere di tipo neurologico (malattie cerebro-vascolari, m di Parkinson, sclerosi multipla, lesioni midollari) o ostruttivo (post-chirurgia pelvica o da calcoli vescicali). L’iperattività del detrusore può essere presente dal 30 al 60% dei casi di OsVe e spesso i sintomi delle due condizioni coincidono (3).
LUTS e DE: l’ischemia tissutale pelvica sembra giocare un ruolo fondamentale nella OsVe e nell’iperattività del detrusore. È stato ipotizzato che il danno muscolare sia determinato dall’ipossia relativa durante la distensione vescicale, seguita da riperfusione post-minzionale (20). L’aterosclerosi dei vasi della regione pelvica che ne deriva può spiegare l’elevata prevalenza della DE nei LUTS. Essendo la PDE5 altamente espressa nel tratto urinario inferiore, il trattamento con farmaci PDE5-inibitori è risultato efficace nel risolvere sia i disturbi urinari da LUTS che la DE (2).
DIAGNOSI
Screening iniziale
I pazienti con LUTS devono inizialmente essere valutati mediante un’attenta anamnesi (assunzione anti-depressivi, diuretici, bronco-dilatatori, anti-istaminici, sintomi neurologici o pregressi traumi), un accurato esame obiettivo (addome, pelvi, perineo e in particolare l’esplorazione rettale per valutare la prostata) e indagini di laboratorio (glicemia, PSA totale, analisi urine). L’urinocoltura non è raccomandata come routine.
La somministrazione del questionario IPSS (International Prostate Symptom Score) può essere utile nel monitoraggio terapeutico.
Pazienti con sintomi e storia suggestivi di IPB e OsVe possono essere trattati empiricamente anche in ambiente non specialistico. Devono invece essere inviati all’urologo pazienti di età < 45 anni o che non rispondono al trattamento empirico.
Test diagnostici di secondo livello
L’iter diagnostico è tuttora controverso.
Tra gli esami non invasivi:
- Uroflussimetria e residuo vescicale post-minzionale (VPR): se combinati, costituiscono un ottimo strumento di screening per OsVe, ma non danno informazioni sull’eventuale presenza di OAB. Il 90% degli uomini con flusso massimo urinario Qmax 300 mL non dà informazioni riguardo all’eziologia dei LUTS (OsVe o OAB) e necessita un completamento diagnostico con studi uro-dinamici (4);
- Ecografia apparato urinario e prostata trans-addominale e/o trans-rettale: utili per misurare lo spessore di parete della vescica, del detrusore, il peso della vescica, il volume prostatico e il VPR (5).
Tra i test diagnostici invasivi:
- Studi uro-dinamici di pressione-flusso: sono il gold standard per la diagnosi di iperattività del detrusore, in particolare nei pazienti neurologici e nei non responder ai trattamenti per OsVe (6);
- Uretro-cistoscopia: da eseguire in caso di sospetta patologia vescicale uretrale e/o prima di interventi chirurgici minimamente invasivi.
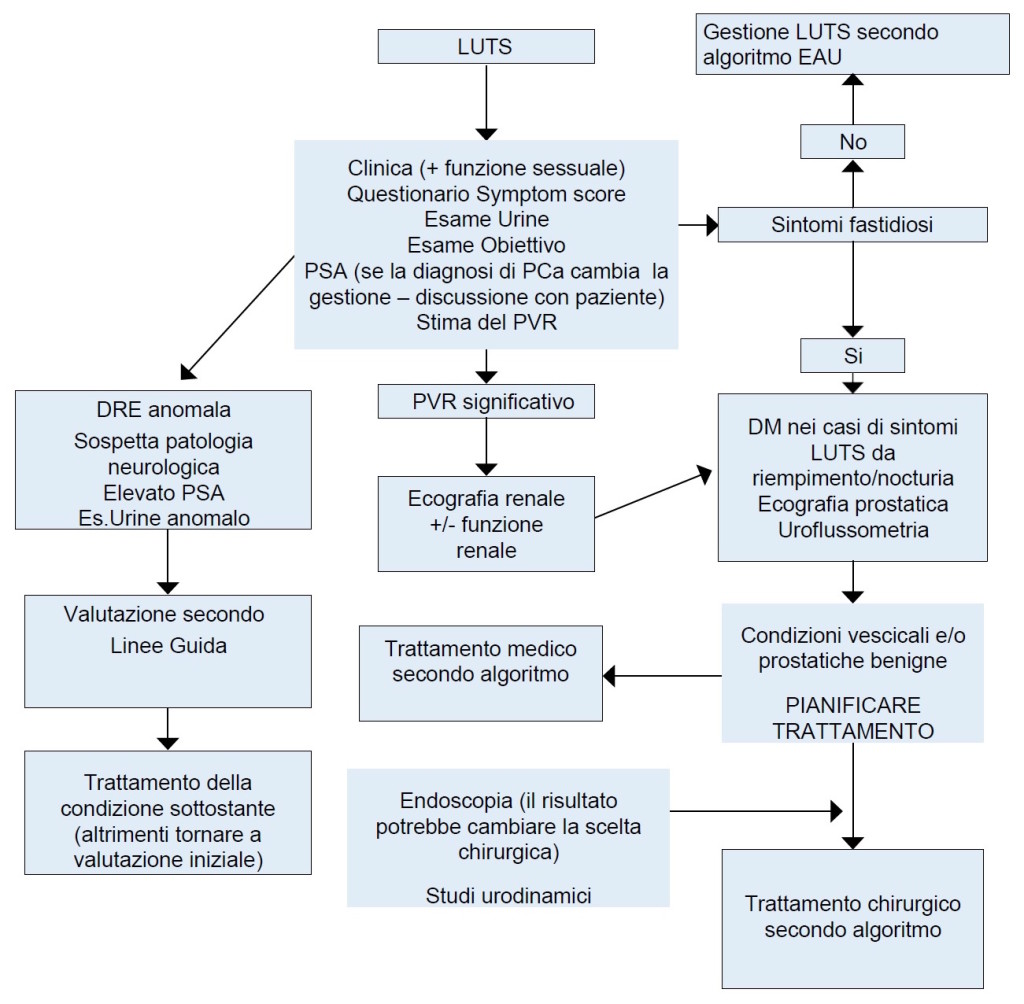
Figura 1: Algoritmo diagnostico (modificato da linee guida EAU 2015)
DRE = esplorazione rettale; DM = diario minzionale; PCa = tumore prostatico; PVR = rsiduo post-minzionale
TRATTAMENTI FARMACOLOGICI (figura 2)
Data l’ampia variabilità sintomatologica, il trattamento andrà per lo più personalizzato, anche considerando che i diversi sintomi possono essere dovuti a OsVe o a OAB o a una combinazione di entrambe.
In via preliminare, possono essere utili regole comportamentali (7), che prevedono di limitare l’assunzione di liquidi o di sostanze a blanda azione diuretica (es. caffeina e alcool) prima di coricarsi o di uscire. Quando prevalgono i sintomi di urgenza, possono essere utili anche esercizi di bio-feedback che promuovono il rilassamento del pavimento pelvico.
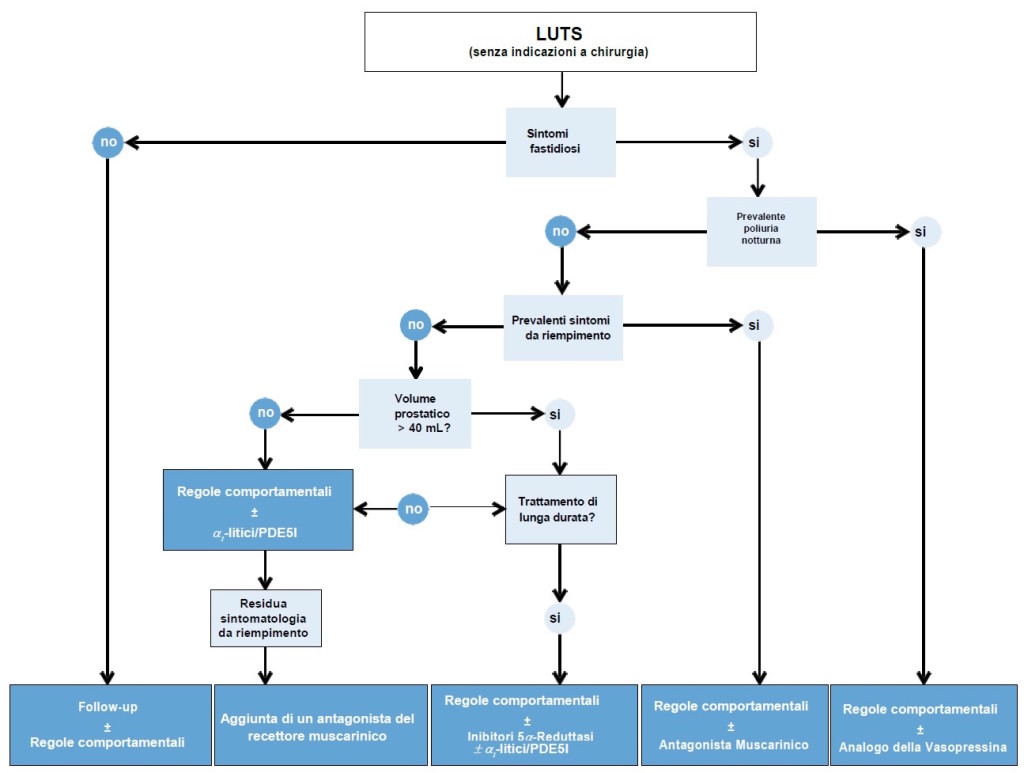
Figura 2: Algoritmo terapeutico medico conservativo (modificato da linee guida EAU 2015)
Trattamento dei LUTS da OsVe
Quando prevalgono i sintomi di svuotamento dovuti a OsVe secondaria a IPB, il trattamento iniziale è farmacologico, specie se i disturbi sono di entità medio-moderata e non vi è indicazione a una soluzione chirurgica. Le opzioni terapeutiche comprendono:
- α-litici (terazosina, doxazosina, tamsulosina, alfuzosina e silodosina): sono farmaci di prima linea nel trattamento della IPB e dei sintomi ad essa correlati. Agiscono rilassando la muscolatura liscia a livello del collo vescicale e della prostata. Tamsulosina e silodosina sono α-litici selettivi, con minori effetti cardio-vascolari (vertigini ed ipotensione) rispetto ai meno selettivi terazosina e doxazosina;
- Inibitori della 5-α reduttasi (finasteride e dutasteride): il blocco competitivo dell’enzima inibisce la conversione del testosterone a DHT; ne deriva atrofia delle cellule epiteliali prostatiche, con una riduzione volumetrica della ghiandola fino al 25% e un miglioramento dei sintomi e del flusso urinario dopo almeno tre mesi (8,9). Gli effetti indesiderati più frequenti sono disfunzione eiaculatoria ed erettile, calo della libido e ginecomastia. Prima dell’utilizzo di questi farmaci, il paziente dovrebbe essere valutato per altre condizioni urologiche, incluso il tumore della prostata. La combinazione di α-litici e inibitori della 5-α reduttasi risulta molto efficace nel miglioramento dei sintomi (10,11).
- Inibitori della fosfodiesterasi tipo 5 (PDE5-I): diversi studi clinici hanno dimostrato che in pazienti affetti da DE l’utilizzo dei PDE5-I ha migliorato anche i LUTS, in presenza di una concomitante IPB (12). In particolare, la somministrazione giornaliera di tadalafil 5 mg ha indicazione specifica nel trattamento dei LUTS con IPB oltre alla DE. La terapia combinata PDE5-I + α-litici sembra avere un beneficio additivo rispetto alla monoterapia (13).
Trattamento dei LUTS da OAB
Laddove prevalgono i sintomi da urgenza/frequenza dovuti a OAB, l’obiettivo è ridurre le contrazioni involontarie del detrusore, mediate dall’azione dell’acetilcolina sui recettori muscarinici (14), utilizzando farmaci anti-colinergici (tolterodina, ossibutinina, darifenacina, solifenacina, fesoterodina, trospio) (15).
Gli effetti indesiderati, legati al blocco dei recettori muscarinici M2, sono secchezza delle fauci, paralisi del muscolo ciliare del cristallino con conseguente visione offuscata, tachicardia, sonnolenza, ridotta motilità gastro-intestinale con costipazione e ridotta funzione cognitiva. Questi farmaci sono controindicati in pazienti con ritenzione gastrica e glaucoma ad angolo chiuso. Poiché gli anti-colinergici possono favorire la ritenzione urinaria, essi dovrebbero essere utilizzati con cautela in quei pazienti con concomitante OsVe e prima di iniziare la terapia deve essere valutato il residuo post-minzionale (< 250-300 mL) (16).
Il mirabegron, agonista β-adrenergico, si è dimostrato utile nel controllo dei sintomi da urgenza/frequenza al pari degli anti-colinergici (17), con maggior profilo di sicurezza sul rischio di ritenzione urinaria, anche se può favorire lo sviluppo di ipertensione arteriosa.
TRATTAMENTI CHIRURGICI (figura 3)
La chirurgia è riservata a casi di scarsa/insoddisfacente risposta al trattamento medico, pazienti con sintomatologia ingravescente nonostante il trattamento, pazienti che scelgono una risoluzione definitiva. Le opzioni chirurgiche possono includere ablazione trans-uretrale in radio-frequenza, laser vaporizzazione della prostata, TURP, prostatectomia.
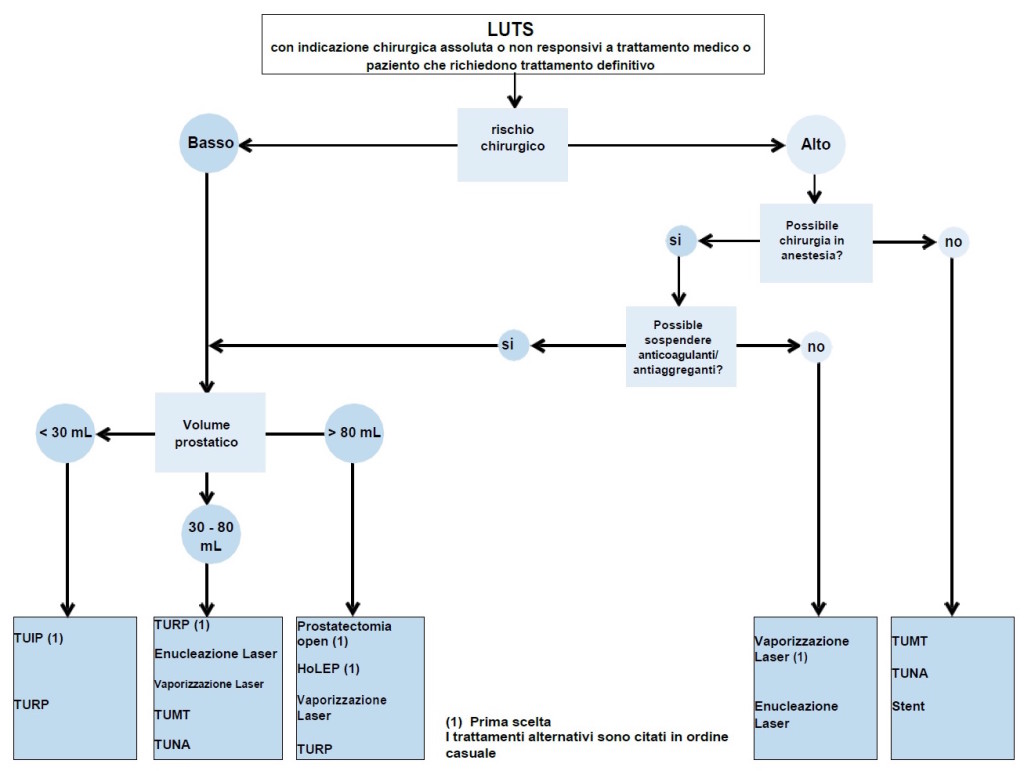
Figura 3: Algoritmo terapeutico di LUTS refrattari a trattamento medico conservativo o in caso di indicazione assoluta alla chirurgia (modificato da linee guida EAU 2015)
HoLEP = enucleazione laser con olmio; TUIP = incisione trans-uretrale della prostata; TUMT = terapia trans-uretrale con micro-onde; TUNA = ablazione trans-uretrale con ago; TURP = resezione prostatica trans-uretrale
BIBLIOGRAFIA
- Taylor BC, Wilt TJ, Fink HA, et al. Prevalence, severity, and health correlates of lower urinary tract symptoms among older men: the MrOS study. Urology 2006, 68: 804-9.
- Braun MH, Sommer F, Haupt G, et al. Lower urinary tract symptoms and erectile dysfunction: co-morbidity or typical “Aging Male” symptoms? Results of the “Cologne Male Survey”. Eur Urol 2003, 44: 588-94.
- Lee JY, Kim DK, Chancellor MB. When to use antimuscarinics in men who have lower urinary tract symptoms. Urol Clin North Am 2006, 33: 531-7.
- AUA Practice Guidelines Committee. AUA guideline on management of benign prostatic hyperplasia (2003). Chapter 1: Diagnosis and treatment recommendations. J Urol 2003, 170: 530-47.
- Bright E, Oelke M, Tubaro A, Abrams P. Ultrasound estimated bladder weight and measurement of bladder wall thickness–useful noninvasive methods for assessing the lower urinary tract? J Urol 2010, 184: 1847-54.
- Dmochowski RR. Bladder outlet obstruction: etiology and evaluation. Rev Urol 2005, 7 Suppl 6: S3-13.
- Burgio KL, Goode PS, Johnson TM, et al. Behavioral versus drug treatment for overactive bladder in men: the Male Overactive Bladder Treatment in Veterans (MOTIVE) Trial. J Am Geriatr Soc 2011, 59: 2209-16.
- Gormley GJ, Stoner E, Bruskewitz RC, et al. The effect of finasteride in men with benign prostatic hyperplasia. The Finasteride Study Group. N Engl J Med 1992, 327: 1185-91.
- Roehrborn CG, Boyle P, Nickel JC, et al. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology 2002, 60: 434-41.
- McConnell JD, Roehrborn CG, Bautista OM, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003, 349: 2387-98.
- Roehrborn CG, Siami P, Barkin J, et al. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the CombAT study. J Urol 2008, 179: 616-21.
- Liu L, Zheng S, Han P, Wei Q. Phosphodiesterase-5 inhibitors for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a systematic review and meta-analysis. Urology 2011, 77: 123-9.
- Gacci M, Corona G, Salvi M, et al. A systematic review and meta-analysis on the use of phosphodiesterase 5 inhibitors alone or in combination with α-blockers for lower urinary tract symptoms due to benign prostatic hyperplasia. Eur Urol 2012, 61: 994-1003.
- Anderson KE. Pharmacology of lower urinary tract smooth muscles and penile erectile tissues. Pharmacol Rev 1993, 45: 253-308.
- Nabi G, Cody JD, Ellis G, et al. Anticholinergic drugs versus placebo for overactive bladder syndrome in adults. Cochrane Database Syst Rev 2006: CD003781.
- McVary KT, Roehrborn CG, Avins AL, et al. Update on AUA guideline on the management of benign prostatic hyperplasia. J Urol 2011, 185: 1793-803.
- Maman K, Aballea S, Nazir J, et al. Comparative efficacy and safety of medical treatments for the management of overactive bladder: a systematic literature review and mixed treatment comparison. Eur Urol 2014, 65: 755-65.