Vincenzo Favilla, Daniele Urzì, Giulio Reale
UOC Urologia, AOU “Policlinico-Vittorio Emanuele”, Università di Catania
Rispetto ad altre neoplasie solide, le neoplasie testicolari presentano elevati tassi di guarigione dopo orchifuniculectomia (80% circa dei seminomi e 70% dei non seminomi) (fig. 1-3).
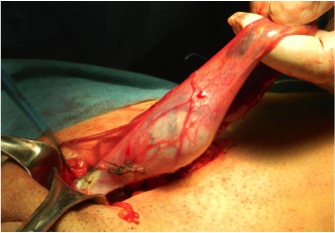
Figura 1: Orchifuniculectomia con accesso chirurgico inguinale. Esteriorizzazione del testicolo e del funicolo spermatico, senza apertura della tunica vaginale.
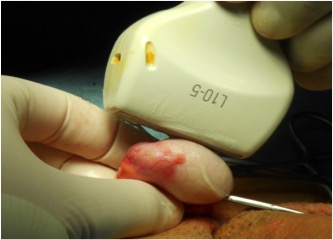
Figura 2: Ecografia intra-operatoria in corso di chirurgia testis-sparing in paziente monorchide con lesione subcentimetrica
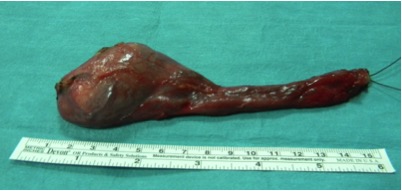
Figura 3: Campione chirurgico di orchifuniculectomia con tunica vaginale integra
Questo è legato soprattutto a diagnosi precoce (lesione testicolare asintomatica ed incidentale all’ecografia), con riscontro prevalentemente di neoplasie ancora in stadio I, più attenta stadiazione al momento della diagnosi, perfezionamento dei trattamenti chirurgici e radioterapici, nonché all’introduzione di protocolli efficaci con chemioterapici derivati dal platino. Va ricordato che tutte le opzioni terapeutiche sovra-indicate possono tuttavia avere gravi ripercussioni sulla fertilità dei pazienti, che devono quindi conservare il seme (crio-conservazione) se interessati alla paternità.
Il trattamento ovviamente varia a seconda del tipo istologico e dello stadio e comprende chirurgia (orchifuniculectomia ed eventuale chirurgia di masse residue a chemioterapia), radioterapia e chemioterapia. In accordo alle recenti linee guida della Società Europea di Urologia del 2016, vengono di seguito riportate le possibili opzioni terapeutiche dopo orchifuniculectomia.
Seminoma stadio I
Sono possibili tre opzioni: sorveglianza, chemioterapia, radioterapia. La scelta terapeutica si basa sulla stratificazione del rischio.
Sorveglianza: se il paziente è compliante e non presenta fattori prognostici sfavorevoli, quali diametro tumorale > 4 cm e/o invasione della rete testis, può essere inserito in un protocollo di sorveglianza (1) (stretto follow-up con radiografia del torace, TC addome, marcatori sierici ed ecografia del testicolo residuo). Il rischio di recidiva a 5 anni con sviluppo di metastasi ai linfonodi retro-peritoneali nei pazienti in sorveglianza varia dal 6 al 15%, in assenza dei due fattori di rischio sovra-indicati (2,3).
Radioterapia: il trattamento dei linfonodi retro-peritoneali con dose frazionata di 20-24 Gy con campo para-aortico o a bastone da hockey (linfonodi retro-peritoneali e linfonodi iliaci omolaterali) riduce il tasso di recidiva all’1-3%. Con le moderne tecniche di trattamento si è notevolmente ridotto il rischio di tossicità grave (a circa il 2%); persistono tuttavia rischi moderati di tossicità gastro-intestinale e di insorgenza di neoplasie secondarie a irradiamento (4-6).
Chemioterapia: un’altra opzione terapeutica che può essere proposta è un singolo ciclo di carboplatino, specie per i pazienti con fattori prognostici sfavorevoli dopo orchiectomia quali: diametro tumorale > 4 cm e/o invasione rete testis. Il trattamento chemioterapico riduce il rischio di recidiva all’1-3% (7,8).
Non seminoma stadio I
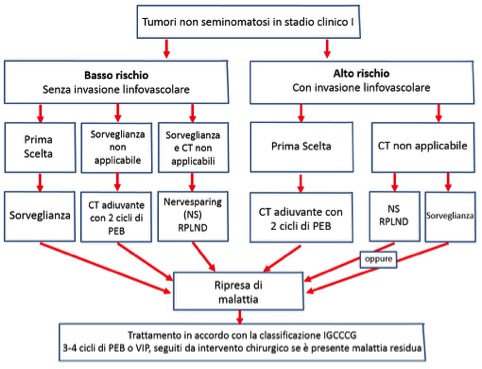
Le opzioni terapeutiche sono: sorveglianza, chemioterapia e linfoadenectomia retro-peritoneale. Anche in questo caso la scelta si basa sulla stratificazione del rischio. In questo caso il fattore prognostico sfavorevole è rappresentato dalla presenza di invasione tumorale linfo-vascolare. Pertanto, nei pazienti con invasione linfo-vascolare è raccomandata la chemioterapia adiuvante con cisplatino, etoposide, bleomicina (un ciclo di PEB). Il trattamento ha una tossicità accettabile e la sopravvivenza libera da recidiva a 8 anni è di circa il 97%, superiore alla linfoadenectomia retro-peritoneale. Al contrario, in assenza di invasione linfo-vascolare, può essere proposto un protocollo di sorveglianza (in pazienti complianti a stretto follow-up), informando il paziente di un rischio di ripresa di malattia pari a circa il 30% e di un’eventuale necessità di chemioterapia di salvataggio. La linfoadenectomia retro-peritoneale può essere offerta a pazienti a basso rischio, che non vogliono (o non possono) seguire protocolli di sorveglianza, così come a pazienti ad alto rischio che non accettano la chemioterapia. Indipendentemente dalle tre opzioni terapeutiche scelte (sorveglianza, chemioterapia o linfoadenectomia retro-peritoneale), in caso di recidiva il trattamento prevede 3 o 4 cicli di PEB, seguiti da resezione chirurgica di eventuale massa residua (9-11) (fig. 4).
Figura 4. Opzioni di trattamento in pazienti con tumore del testicolo non seminomatoso in stadio clinico I (CT = chemioterapia; PEB = cisplatino, etoposide, bleomicina; NS = nerve sparing; RPLND = linfoadenectomia retro-peritoneale; IGCCCG = International Germ Cell Cancer Collaborative Group; VIP = etoposide, cisplatino, ifosfamide).
Seminoma stadio IIa/IIb (tumori metastatici)
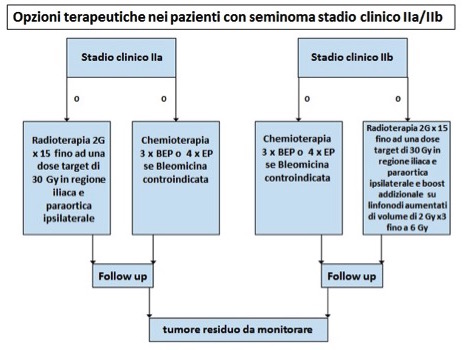
È raccomandata la radioterapia adiuvante para-aortica o a bastone da hockey (30-36 Gy), con tassi di sopravvivenza libera da recidiva di circa il 90%. Una valida opzione è la chemioterapia con tre cicli di PEB o 4 cicli di EP (etoposide, cisplatino) (12,13) (fig. 5).
Figura 5. Opzioni terapeutiche nei pazienti con seminoma stadio clinico IIa/IIb (BEP = cisplatino, etoposide, bleomicina; EP = cisplatino, etoposide)
Non seminoma stadio IIa/IIb (tumori metastatici)
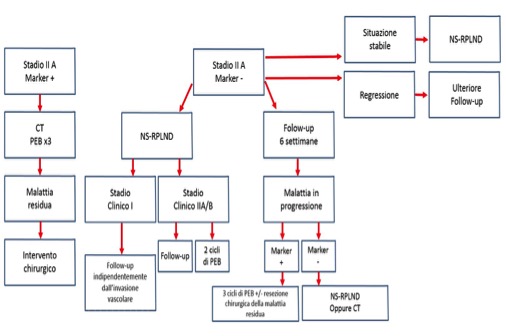
Le opzioni sono chemioterapia (tre cicli di PEB) e linfoadenectomia retro-peritoneale, in relazione alla presenza di marcatori tumorali positivi e/o negativi e alla classificazione prognostica IGCCCG (International Germ Cell Consensus Classification Group) (14) (fig. 6).
Figura 6. Algoritmo diagnostico post-orchiectomia in relazione ai fattori di rischio individuali in pazienti con tumore del testicolo non seminomatoso in stadio clinico IIA. CT = chemioterapia; PEB = cisplatino, etoposide, bleomicina; NS = nerve sparing; RPLND = linfoadenectomia retro-peritoneale; IGCCCG = International Germ Cell Cancer Collaborative Group; VIP = etoposide, cisplatino, ifosfamide
Tumori germinali metastatici avanzati (seminoma e non seminomi in stadio ≥ IIC)
Il trattamento raccomandato è la chemioterapia (3 cicli di PEB o 4 cicli di EP), sulla base della classificazione prognostica dell’IGCCCG. La chemioterapia può essere seguita da eventuale chirurgia di massa residua retro-peritoneale; in caso di nuova recidiva, è raccomandata una chemioterapia di seconda linea (terapia di salvataggio) (15-17).
Bibliografia
- Groll RJ, et al. A comprehensive systematic review of testicular germ cell tumor surveillance. Crit Rev Oncol Hematol 2007, 64: 182-97.
- Aparicio J, et al. Multicenter study evaluating a dual policy of postorchiectomy surveillance and selective adjuvant single-agent carboplatin for patients with clinical stage I seminoma. Ann Oncol 2003, 14: 867-72.
- Aparicio J, et al. Prognostic factors for relapse in stage I seminoma: a new nomogram derived from three consecutive, risk-adapted studies from the Spanish Germ Cell Cancer Group (SGCCG). Ann Oncol 2014, 25: 2173-8.
- Oliver RT, et al. Randomized trial of carboplatin versus radiotherapy for stage I seminoma: mature results on relapse and contralateral testis cancer rates in MRC TE19/EORTC 30982 study (ISRCTN27163214). J Clin Oncol 2011, 29: 957-62.
- Oliver RT, et al. Radiotherapy versus single-dose carboplatin in adjuvant treatment of stage I seminoma: a randomised trial. Lancet 2005, 366: 293-300.
- Mead GM, et al. Randomized trials in 2466 patients with stage I seminoma: patterns of relapse and follow-up. J Natl Cancer Inst 2011, 103: 241-9.
- van den Belt-Dusebout AW, et al. Treatment-specific risks of second malignancies and cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol 2007, 25: 4370-8.
- Freedman LS, et al. Histopathology in the prediction of relapse of patients with stage I testicular teratoma treated by orchidectomy alone. Lancet 1987, 2: 294-8.
- Read G, et al. Medical Research Council prospective study of surveillance for stage I testicular teratoma. J Clin Oncol 1992, 10: 1762-8.
- Kollmannsberger C, et al. Non-risk-adapted surveillance for patients with stage I nonseminomatous testicular germ-cell tumors: diminishing treatment-related morbidity while maintaining efficacy. Ann Oncol 2010, 21: 1296-301.
- Nichols CR, et al. Active surveillance is the preferred approach to clinical stage I testicular cancer. J Clin Oncol 2013, 31: 3490-3.
- Classen J, et al. Radiotherapy for stages IIA/B testicular seminoma: final report of a prospective multicenter clinical trial. J Clin Oncol 2003, 21: 1101-6.
- Chung PW, et al. Stage II testicular seminoma: patterns of recurrence and outcome of treatment. Eur Urol 2004, 45: 754-9.
- Jayram G, et al. Management of good-risk metastatic nonseminomatous germ cell tumors of the testis: current concepts and controversies. Indian J Urol 2010, 26: 92-7.
- Bokemeyer C, et al. Metastatic seminoma treated with either single agent carboplatin or cisplatin-based combination chemotherapy: a pooled analysis of two randomised trials. Br J Cancer 2004, 91: 683-7.
- Fizazi K, et al. A risk-adapted study of cisplatin and etoposide, with or without ifosfamide, in patients with metastatic seminoma: results of the GETUG S99 multicenter prospective study. Eur Urol 2014, 65: 381-6.
- de Wit R. Refining the optimal chemotherapy regimen in good prognosis germ cell cancer: interpretation of the current body of knowledge. J Clin Oncol 2007, 25: 4346-9.