Andrea Garolla
Dipartimento di Medicina, Unità di Andrologia e Medicina Riproduttiva, Università di Padova
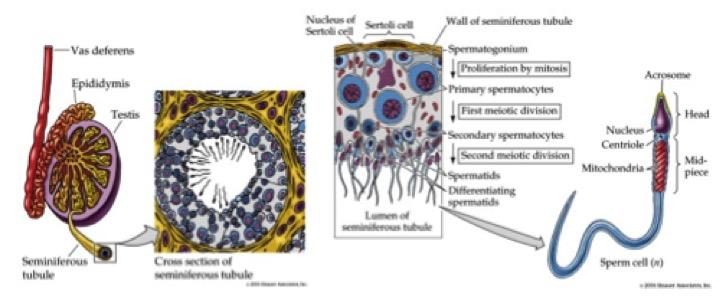
Il processo di produzione degli spermatozoi (spermatogenesi) avviene, secondo una precisa organizzazione spaziale, all’interno del parenchima testicolare (fig 1).
Figura 1. Da Purves W, Sadava D. Life: the science of biology. 7th Ed. Sunderland MA: Sinauer Associates, 2003.
Tale struttura è costituita dai tubuli seminiferi e dallo stroma, che circonda i tubuli e contiene le cellule di Leydig a funzione endocrina. I tubuli seminiferi sono strutture organizzate in modo convoluto, dove ha luogo la spermatogenesi, le cui estremità sboccano nella rete testis, posta a livello del mediastino testicolare. Dalla rete testis si dipartono i condotti efferenti che confluiscono a formare l’epididimo.
La parete dei tubuli seminiferi è costituita da epitelio germinativo, che comprende, accanto alle cellule germinali in diverso stato differenziativo, le cellule del Sertoli, cellule di sostegno non spermatogeniche, con importanti funzioni endocrine. Le cellule germinali in stadio precoce di sviluppo si trovano perifericamente, mentre quelle negli stadi tardivi aggettano verso il lume.
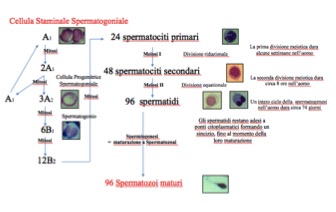
Il processo attraverso il quale gli elementi cellulari germinativi passano dalla periferia al lume dura 74 giorni circa (fig 2) e comprende tre fasi (1):
- una fase di proliferazione mitotica, che coinvolge diversi tipi cellulari, detti spermatogoni;
- una fase meiotica, effettuata da cellule dette spermatociti, che consente la ripartizione del genoma in cellule aploidi (spermatidi) e durante la quale avvengono anche tutti i processi collegati alla ricombinazione genetica (crossing-over);
- una fase finale di differenziazione cellulare senza ulteriore divisione, che porta alla formazione dello spermatozoo maturo, attraverso una serie di mutamenti morfologici noti con il termine di spermiogenesi.
Figura 2. La spermatogenesi umana
Gli spermatogoni sono localizzati in corrispondenza della lamina basale dell’epitelio, mentre gli stadi successivi della spermatogenesi avvengono in posizioni più distali. Gli spermatozoi si localizzano infine a livello del lume del tubulo, ove vengono rilasciati per raggiungere l’epididimo.
Gli spermatogoni derivano da cellule germinali primordiali, che durante le fasi precoci della embriogenesi sono migrate a livello delle creste germinali; la spermatogenesi inizia però solamente durante la pubertà, quando avviene la canalizzazione dei cordoni sessuali, con formazione dei tubuli seminiferi. In base alle loro caratteristiche morfologiche e ultrastrutturali, nell’uomo si possono distinguere diversi tipi di spermatogoni: di tipo A, a loro volta distinti in A dark (Ad) e A pale (Ap), e di tipo B. Con la loro attività proliferativa gli spermatogoni eseguono un duplice compito: mantenere un pool di cellule indifferenziate e avviare il processo differenziativo, che consiste nella produzione dei diversi tipi di spermatogoni e che proseguirà poi con la fase meiotica e la spermiogenesi. Tale duplice funzione garantisce che un adeguato numero di gameti funzionali sia prodotto in modo continuativo nel corso della vita adulta di un individuo. Il meccanismo della spermatogenesi prende quindi inizio a partire dagli spermatogoni Ad, che rappresentano le cellule che in seguito a divisione mitotica producono sia nuove cellule staminali Ad, sia spermatogoni più differenziati Ap. Dalla divisione mitotica di questi ultimi, derivano gli spermatogoni di tipo B, che, attraverso una successiva divisione mitotica, danno origine agli spermatociti primari. A questo punto prende il via il processo meiotico, che implica due successive divisioni cellulari precedute da una sola duplicazione del DNA, con formazione finale di 4 cellule dotate di corredo cromosomico aploide. Durante la prima divisione meiotica, che coinvolge gli spermatociti primari, i cromosomi omologhi, che appaiono costituiti ognuno da due cromatidi appaiati, dopo il crossing-over si separano in due cellule figlie, gli spermatociti secondari, che pertanto presentano un numero dimezzato di cromosomi (numero aploide). Tuttavia, poiché ogni cromosoma è composto da due cromatidi appaiati, il contenuto di DNA totale è ancora equivalente a quello delle cellule somatiche. La seconda divisione meiotica ha luogo dopo una fase relativamente breve e durante questa i cromatidi si separano senza che avvenga replicazione del DNA, e si distribuiscono alle cellule figlie con un meccanismo simile a quello della divisione mitotica. Le cellule figlie vengono chiamate spermatidi e contengono un corredo aploide di cromosomi, quindi dimezzato rispetto a quello delle cellule somatiche.
Vediamo però quali sono in dettaglio le tappe che caratterizzano tale processo. Il processo meiotico inizia quando lo spermatogonio di tipo B perde il suo contatto con la membrana basale per andare a costituire lo spermatocita primario allo stadio di pre-leptotene. Quest’ultimo va incontro a sintesi e condensazione del DNA dei singoli cromosomi, che assumono l’aspetto di esili filamenti nel nucleo (stadio di leptotene). A questo punto ciascun cromosoma presenta una coppia di cromatidi. Durante lo stadio di zigotene ha luogo l’appaiamento dei cromosomi omologhi noto come sinapsi. Questo comporta la formazione di grossolani filamenti di cromatina, che progressivamente si ispessiscono e si accorciano, sino a dare la tipica configurazione dello spermatocita pachitene. In questo stadio il nucleo e il citoplasma si espandono progressivamente in volume, tanto che tali cellule appaiono come le più voluminose tra le cellule germinali. Ogni coppia di cromosomi è costituita da 4 spermatidi. Durante questo stadio vi è scambio di materiale genetico fra i cromosomi di origine materna e quelli di origine paterna, con rotture e riparazioni del DNA. Seguono poi due brevi stadi: lo stadio di diplotene, caratterizzato dalla parziale separazione delle coppie di cromosomi omologhi, e lo stadio di diacinesi, caratterizzato dalla successiva dissoluzione della membrana nucleare. In questa fase i cromosomi si allineano su un fuso e ciascun componente della coppia di cromosomi omologhi si muove verso il polo opposto del fuso, formando cellule figlie, denominate spermatidi rotondi. La trasformazione dello spermatide rotondo, che presenta corredo cromosomico aploide, in spermatozoo maturo è denominata spermiogenesi. Durante questa fase gli spermatidi subiscono una modificazione della forma e della dimensione nucleare, che culmina, al termine della spermiogenesi, con la sostituzione degli istoni con protamine, proteine ricche in arginina e cisteina, che favoriscono l’elevata compattazione del DNA tipica degli spermatozoi (2).
Nell’uomo la spermatogenesi richiede l’azione di una vasta gamma di molecole (essenzialmente di tipo ormonale), ciascuna delle quali svolge un ruolo importante nel normale funzionamento dell’epitelio seminifero. Questi messaggeri ormonali sono critici, non solo per la regolazione dello sviluppo delle cellule germinali, ma anche per la proliferazione e il corretto funzionamento di cellule somatiche, necessarie per un corretto sviluppo del testicolo (3):
- le cellule interstiziali di Leydig, la cui funzione principale è la produzione del testosterone;
- le cellule mioidi, che circondano i tubuli seminiferi e forniscono supporto meccanico a queste strutture;
- le cellule del Sertoli, localizzate a stretto contatto con le cellule spermatogenetiche, che producono numerose molecole che contribuiscono al corretto svolgimento del processo spermatogenetico e forniscono supporto meccanico alle cellule germinali; inoltre, mediante strette giunzioni inter-cellulari, formano la barriera emato-testicolare, che crea un micro-ambiente biochimico specifico, in cui proliferano le cellule germinali (4).
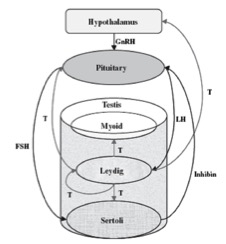
Ciascuno di questi tipi cellulari rappresenta un target diretto di uno o più ormoni, la cui azione è essenziale per il corretto mantenimento della spermatogenesi e, quindi, per la preservazione della fertilità maschile. La spermatogenesi è finemente regolata da fattori ormonali prodotti a livello ipotalamo-ipofisario e a livello testicolare. Da tempo è noto che per la realizzazione della spermatogenesi sono indispensabili le gonadotropine prodotte dall’ipofisi anteriore in risposta a un releasing-hormone ipotalamico: FSH ed LH, ormoni glicoproteici ipofisari, agiscono direttamente sul testicolo e contribuiscono all’induzione e al mantenimento della spermatogenesi. Nell’uomo l’espressione del recettore dell’FSH è limitata alle cellule del Sertoli, mentre i recettori dell’LH sono stati localizzati sia a livello delle cellule di Leydig che a livello delle cellule spermatogenetiche. Anche il testosterone, prodotto dalle cellule interstiziali di Leydig, riveste un ruolo essenziale nel mantenimento della spermatogenesi durante l’immediata fase post-puberale e nell’età adulta (fig 3).
Figura 3. Regolazione ormonale della spermatogenesi
(GnRH = ormone stimolante il rilascio di gonadotropine; FSH = ormone follicolo-stimolante; LH = ormone luteinizzante; T = testosterone)
L’incremento massimo del numero delle cellule germinali avviene fra i 3 e i 6 mesi dopo la nascita, tuttavia l’attività proliferativa si mantiene, anche se molto ridotta, sino alla pubertà. Le cellule germinali vanno incontro a mitosi, ma non alle successive divisioni meiotiche e appaiono dislocate centralmente nei tubuli seminiferi. Durante la pubertà avverrebbe la loro migrazione a ridosso della membrana basale dei tubuli, che coincide con l’inizio della spermatogenesi. Anche le cellule del Sertoli si dividono intensamente nei primi tre mesi dopo la nascita e tale attività proliferativa sembra decrescere progressivamente sino alla pubertà, quando perdono definitivamente la capacità di dividersi e acquisiscono, invece, funzioni specializzate, come ad esempio la formazione della barriera emato-testicolare. L’inizio della spermatogenesi avviene in epoca puberale, quando la produzione di FSH ed LH si eleva, evento che segna l’inizio della pubertà. Perché ciò avvenga, è indispensabile un’interazione tra le due gonadotropine, LH ed FSH. L’FSH è in grado di stimolare direttamente la spermatogenesi, anche in presenza di bassi livelli di LH e testosterone, incrementando la produzione sertoliana di ABP (carrier intra-cellulare di testosterone), aumentando in questo modo la concentrazione intra-testicolare del testosterone stesso. Analogamente, l’LH in presenza di bassi livelli di FSH è in grado di indurre la spermatogenesi, aumentando i livelli intra-testicolari di testosterone. Prima della pubertà, l’epitelio seminifero consiste di elementi germinali e sertoliani entrambi immaturi. L’esposizione cronica del testicolo peri-pubere al testosterone dà inizio alla spermatogenesi e la stimolazione combinata da parte delle due gonadotropine induce la maturazione delle cellule del Sertoli. L’FSH e il testosterone sembrano quindi modulare indirettamente la spermatogenesi, attraverso il loro legame alle cellule del Sertoli. In particolare, l’FSH pare esercitare un’azione soprattutto favorente i processi meiotici, mentre il testosterone avrebbe un ruolo prominente sulla spermiogenesi.
Dopo la pubertà l’epitelio seminifero appare costituito da elementi germinali disposti a strati, che corrispondono a successive generazioni di questi elementi procedendo dalla lamina propria verso il lume del tubulo e da elementi sertoliani maturi che occupano tutta l’altezza dell’epitelio, intercalati tra gruppi di cellule germinali, ove restano come elementi stabili. È però con la fase di mantenimento della spermatogenesi che il processo di spermatogenesi conduce alla produzione di spermatozoi nel testicolo adulto. Il livello a cui la spermatogenesi è mantenuta non è costante, ma è soggetto a regolazioni fisiologiche. Ad esempio, nell’uomo, ci sono fluttuazioni stagionali, con una diminuzione durante il periodo estivo.
Come per l’induzione della spermatogenesi, anche per il suo mantenimento l’FSH agisce in sinergia con l’LH. Studi genetici recenti indicano che il ruolo primario dell’FSH nella spermatogenesi è la stimolazione della proliferazione delle cellule del Sertoli durante la fase pre-puberale e che il numero delle cellule del Sertoli determina in maniera importante il numero delle cellule germinali. Molti studi hanno dimostrato che nell’uomo l’FSH regola la popolazione spermatogoniale, poiché la diminuzione della conta spermatica indotta dalla soppressione dei livelli di gonadotropine risulta in un marcato decremento degli spermatogoni di tipo B, probabilmente dovuta a una mancata progressione da spermatogoni Ap a B: quest’effetto rappresenta il risultato della diminuzione dei livelli di FSH piuttosto che del concomitante declino dei valori sierici del testosterone (5). Se una ridotta disponibilità di FSH porta a una riduzione della spermatogenesi, aumentate concentrazioni di FSH possono amplificare il processo, come dimostrato in scimmie normali trattate con dosi sovra-fisiologiche di FSH e nel testicolo contro-laterale di uomini sottoposti ad emi-orchiectomia. In queste situazioni l’incremento della stimolazione con FSH esercita la sua funzione su strutture testicolari normali. Nei soggetti oligozoospermici trattati con FSH non sempre si determina però un aumento consistente della concentrazione di spermatozoi (6). È stato dimostrato, infatti, che solo soggetti con normale spermatogenesi e assenza di difetti maturativi sono in grado di rispondere al trattamento con FSH con un miglioramento dei parametri seminali e con un aumento della capacità di fertilizzare in vitro (7). Tuttavia, anche dopo selezione dei pazienti con caratteristiche adeguate al trattamento, una parte di loro non mostra miglioramenti dopo la terapia. Pertanto, manca ancora una completa comprensione della fisiopatologia della spermatogenesi, al fine di facilitare l’interpretazione delle correlazioni genotipo/fenotipo e permettere la definizione di nuove categorie diagnostiche e terapeutiche (8).
Bibliografia
- Kierszenbaum AL. Mammalian spermatogenesis in vivo and in vitro: a partnership of spermatogenic and somatic cell lineages. Endocr Rev 1994, 15: 116-34.
- Sofikitis N, et al. Hormonal regulation of spermatogenesis and spermiogenesis. J Ster Biochem Mol Biol 2008, 109: 323-30.
- McLachlan RI, et al. Identification of specific sites of hormonal regulation in spermatogenesis in rats, monkeys and man. Rec Prog Horm Res 2002, 57: 149-79.
- Griswold MD. The central role of Sertoli cells in spermatogenesis. Semin Cell Dev Biol 1998, 9: 411-6.
- McLachlan RI, et al. The hormonal regulation of spermatogenesis in primates and man: insights for the development of the male contraceptive. J Androl 2002, 23: 149-62.
- Foresta C, et al. FSH in the treatment of oligozoospermia. Mol Cell Endocrinol 2000, 161: 89-97.
- Garolla A, et al. FSH treatment in infertile males candidate to assisted reproduction improved sperm DNA fragmentation and pregnancy rate. Endocrine 2016, DOI: 10.1007/s12020-016-1037-z.
- Simoni M, et al. Treatment with human, recombinant FSH improves sperm DNA fragmentation in idiopathic infertile men depending on the FSH receptor polymorphism p.N680S: a pharmacogenetic study. Hum Reprod 2016, 31: 1960-9.