Andrea Garolla
Dipartimento di Medicina, Unità di Andrologia e Medicina Riproduttiva, Università di Padova
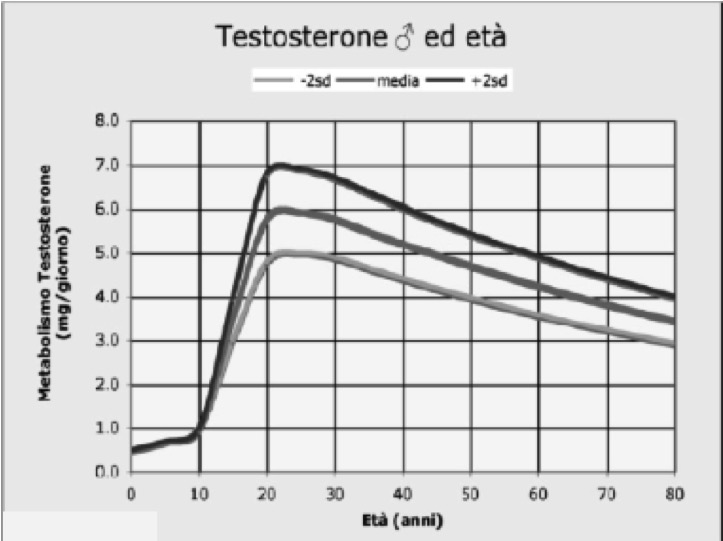
I testicoli, oltre alla produzione di spermatozoi, sono preposti alla secrezione degli ormoni sessuali maschili, in particolare di testosterone (T). La produzione degli ormoni da parte dei testicoli è evidente fin dalla nascita, aumenta intorno alla pubertà e si mantiene per tutta l’età adulta, fino a manifestare un declino in età avanzata (fig 1).
Figura 1. Produzione di testosterone nelle diverse età della vita (modificato da: Williams Textbook of Endocrinology 10° edizione)
Le cellule del Sertoli, oltre a interagire con le cellule della spermatogenesi, svolgono una funzione endocrina attraverso la produzione di ABP (androgen-binding protein), che concentra il testosterone favorendo la spermatogenesi, e di inibina, che agisce con meccanismo di feed-back negativo a livello ipotalamo-ipofisario, inibendo rispettivamente la produzione di GnRH e FSH.
Le cellule di Leydig, poste nell’interstizio, producono ormoni androgeni, in particolare il testosterone, e l’insulin-like factor 3 (INSL3), un ormone peptidico coinvolto nella discesa testicolare, i cui livelli aumentano marcatamente alla pubertà.
Le cellule di Sertoli e le cellule di Leydig producono anche una piccola quantità di estrogeni, che svolgono varie azioni: feed-back negativo a livello centrale, modulazione della spermatogenesi e chiusura delle epifisi ossee.
Infine, il testicolo esercita un ruolo chiave nella produzione della forma attiva della vitamina D (25-OH vitamina D), fondamentale per il normale processo di formazione e omeostasi ossea.
Il T viene sintetizzato dal testicolo (5-6 mg/24 ore) attraverso i processi enzimatici della steroidogenesi a partire dal colesterolo. Il T circola nel plasma per il 2% circa libero, per il 48% legato alle albumine e per il restante 50% legato alla sex hormone-binding globulin (SHBG).
La maggior parte del T plasmatico viene captata e metabolizzata a livello epatico, con formazione di numerosi metaboliti inattivi che vengono escreti nelle urine.
Il testicolo produce inoltre, in minor quantità, androstenedione, deidroepiandrosterone (DHEA), diidrotestosterone (DHT) ed estradiolo (E2). Il 95% della produzione giornaliera di T proviene dal testicolo, mentre la produzione giornaliera di DHT ed E2 deriva per l’80% dalla conversione periferica dei precursori di origine testicolare e surrenale e solo per il 20% dal testicolo. Una piccola frazione del T circolante (circa lo 0.3%) è convertita in E2 attraverso l’enzima aromatasi localizzato nel tessuto adiposo, nel fegato, nel muscolo, nei follicoli piliferi, nelle cellule di Leydig e di Sertoli e nel SNC. In molti tessuti bersaglio il T viene convertito nel più potente androgeno DHT dall’isoenzima microsomiale 5α-reduttasi.
Gli ormoni testicolari hanno come effetto principale quello di determinare, nell’organismo maschile, alla pubertà, lo sviluppo dell’apparato genitale e dei caratteri sessuali secondari. Gli ormoni testicolari agiscono, infatti, a livello dell’apparato genitale maschile determinando l’accrescimento del pene, della prostata e delle vescicole seminali e il mantenimento del processo di maturazione cellulare nell’epitelio seminale. Al di fuori dell’apparato genitale gli ormoni testicolari promuovono lo sviluppo e il mantenimento di quel complesso di tratti somatici e comportamentali (caratteri sessuali secondari) che sono propri del maschio, come tono della voce, distribuzione dei peli e del pannicolo adiposo, sviluppo delle masse muscolari, sviluppo dello scheletro, aggressività, interesse nei confronti dell’altro sesso. Gli ormoni testicolari hanno inoltre un importante effetto anabolizzante, in quanto stimolano in tutti i tessuti (particolarmente nel tessuto muscolare) la sintesi di nuove proteine e nel tessuto osseo facilitano i processi di ossificazione.
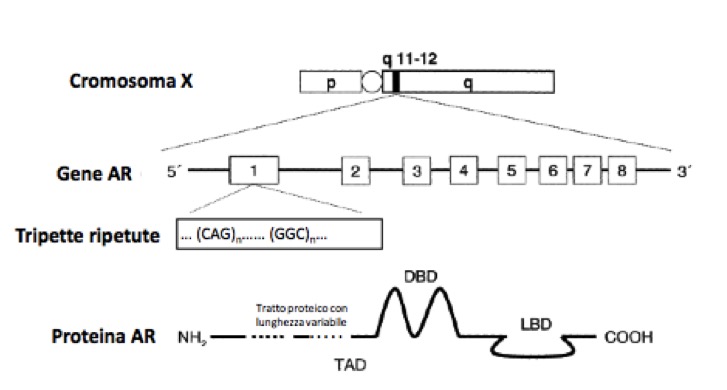
Il T e i suoi metaboliti attivi agiscono su diversi tessuti bersaglio, legandosi a uno specifico recettore nucleare, il recettore degli androgeni (fig 2), con diversi effetti (modulati dalla loro rispettiva affinità per il recettore e/o dalle loro concentrazioni a livello dei tessuti sensibili):
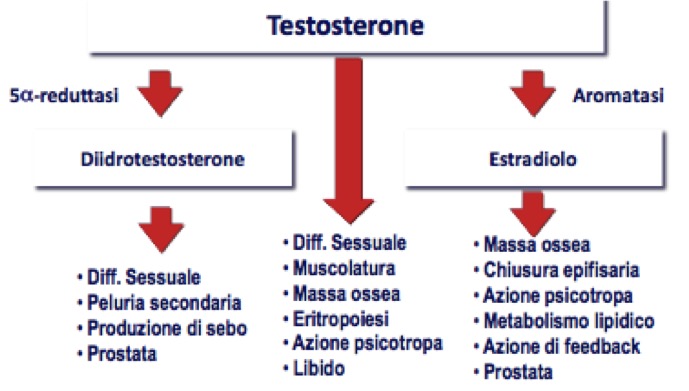
- DHT agisce inducendo la differenziazione sessuale, stimolando la peluria secondaria, inducendo la produzione di sebo e mantenendo il trofismo della ghiandola prostatica;
- T induce la differenziazione sessuale e la spermatogenesi, stimola lo sviluppo e il trofismo della muscolatura e della massa ossea, stimola l’eritropoiesi, mantiene il tono dell’umore e stimola la libido;
- E2, derivato da T per aromatizzazione, contribuisce, tramite il suo recettore specifico, a formazione e maturazione dell’osso, svolge azione psicotropa, controlla il metabolismo lipidico e il trofismo della prostata (fig 3).
Figura 2. Il recettore degli androgeni (modificato da Ceccato F, Zuccarello D, Selice R, Foresta C. Nuove prospettive sulla sindrome di Klinefelter. GIMSeR 2006, 13: 127-39).
Figura 3. Effetti del testosterone (modificato da: Endocrinology Male Hypogonadism, Cleveland Clinic)
In generale, una significativa riduzione della produzione di ormoni testicolari determina la condizione di ipogonadismo. Se questo si instaura prima della pubertà, il soggetto non sviluppa i caratteri sessuali secondari (eunucoidismo) e presenta ipotrofia testicolare, ginecomastia, riduzione dei peli corporei con distribuzione femminile, scarsa libido, disfunzione erettile, infertilità, osteoporosi, ridotta muscolatura, astenia, ridotta forza fisica, ridotta massa magra, obesità addominale e anemia.
Bibliografia
- Traish AM, Miner MM, Morgentaler A, Zitzmann M. Testosterone deficiency. Am J Med 2011, 124: 578-87.
- Bhasin S, Cunningham GR, Hayes FJ, et al. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010, 95: 2536-59.
- Foresta C, Selice R, De Toni L, et al. Altered bone status in unilateral testicular cancer survivors: role of CYP2R1 and its luteinizing hormone-dependency. J Endocrinol Invest 2013, 36: 379-84.